SEBA Class 10 Science Chapter 5 MCQs: মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন | Periodic Classification of Elements Most Important MCQs Assam HSLC
SEBA Class 10 Science Chapter 5 MCQs Periodic Classification of Elements (মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন) for HSLC 2026
Enhance your preparation for HSLC 2026 with SEBA Class 10 Science Chapter 5 MCQs Periodic Classification of Elements (মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন), a crucial chapter for Assamese Medium students. This resource is tailored for Class 10 board exam aspirants, offering meticulously crafted multiple-choice questions aligned with the SEBA syllabus.
These SEBA Class 10 Science Chapter 5 MCQs cover essential topics such as Dobereiner’s Triads, Newlands’ Law of Octaves, Mendeleev’s Periodic Table, Modern Periodic Table, and trends in periodic properties like atomic size, electronegativity, and valency. Designed to mirror the HSLC exam format, these questions ensure comprehensive preparation.
Developed based on the NCERT textbook and SEBA guidelines, each SEBA Class 10 Science Chapter 5 MCQ includes detailed explanations in Assamese to facilitate clear understanding. Logical reasoning accompanies every answer, making this an effective tool for mastering the Periodic Classification of Elements.
Whether studying the structure of the periodic table or exploring periodic trends, these SEBA Class 10 Science Chapter 5 MCQs Periodic Classification of Elements boost your confidence for the HSLC 2026 exam. Complement your learning with our Chapter 5 Detailed Notes and the official NCERT Class 10 Science Book for deeper insights.
মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন (Periodic Classification of Elements) – 50 MCQ
Knowledge-Based Questions (1–15)
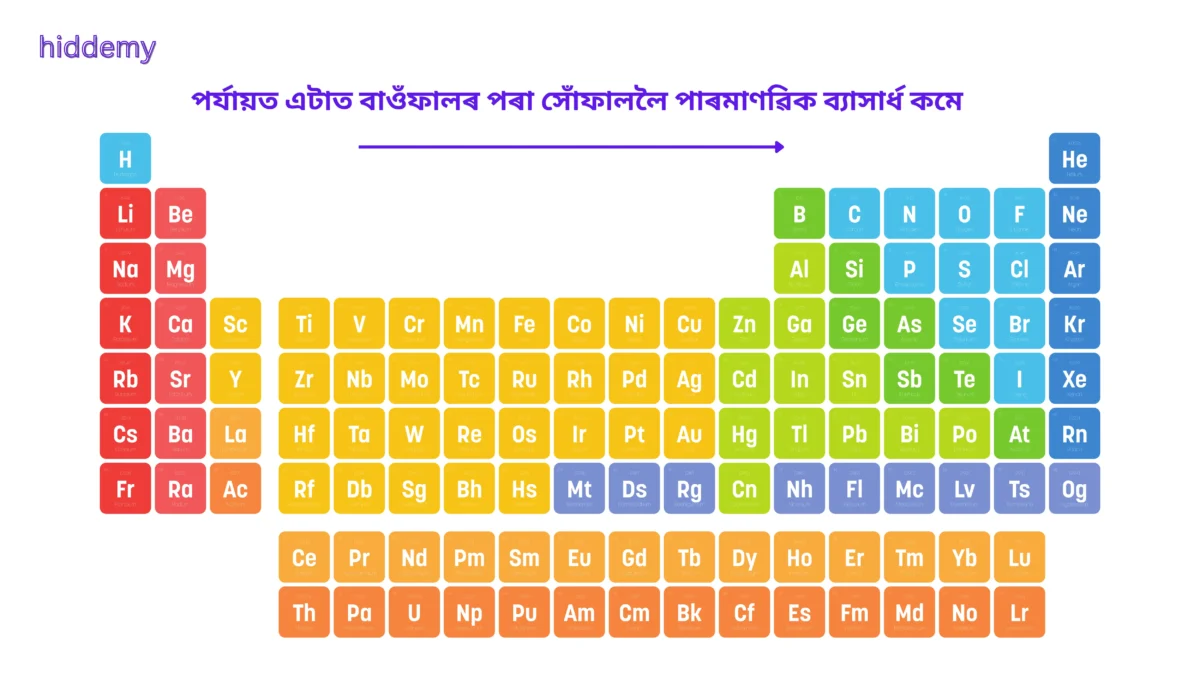
1. মৌলৰ পৰ্যাবৃত্ত তালিকাৰ পৰ্যায়ত এটাত বাওঁফালৰ পৰা সোঁফাললৈ পাৰমাণৰিক ব্যাসাৰ্ধ ক্ৰমান্বয়ে?
(a) বাঢ়ে
(b) কমে
(c) একেই থাকে
(d) ওপৰৰ কোনোটোৱেই নহয়
উত্তৰ: (b) কমে
ব্যাখ্যা: পৰ্যায় এটাত বাওঁফালৰ পৰা সোঁফাললৈ গ’লে নিউক্লীয় আধান বৃদ্ধি পায়। ফলত ইলেকট্রনবোৰ নিউক্লিয়াছৰ পিনে আকৰ্ষিত হৈ পাৰমাণৰিক ব্যাসাৰ্ধ কমি যায়।
2. এটা পৰমাণুৰ ইলেকট্রনীয় বিন্যাস 2, 8, 7। তলৰ মৌলবোৰৰ কোনটোৰ সৈতে ইয়াৰ ৰাসায়নিক সাদৃশ্য থাকিব?
(a) N (7)
(b) F (9)
(c) P (15)
(d) Ar (18)
উত্তৰ: (b) F (9)
ব্যাখ্যা: 2, 8, 7 বিন্যাসৰ মৌলৰ যোজক ইলেকট্রন 7। ফ্লুৰিন (F)ৰ বিন্যাস 2, 7, যাৰ যোজক ইলেকট্রনো 7। সেয়েহে ইয়াৰ ৰাসায়নিক ধৰ্ম ফ্লুৰিনৰ সৈতে সাদৃশ্যপূৰ্ণ।
3. মৌল X-য়ে XCl সংকেতৰ ক্ল’ৰাইড গঠন কৰে আৰু ইয়াৰ গলনাংক উচ্চ। এই মৌলটো তলৰ কোনটোৰ সৈতে একে বৰ্গত থকাৰ সম্ভাৱনা সৰ্বাধিক?
(a) Na
(b) Mg
(c) Al
(d) Si
উত্তৰ: (a) Na
ব্যাখ্যা: XCl গঠন কৰা মৌলৰ যোজ্যতা 1 আৰু উচ্চ গলনাংকৰ হোৱাৰ বাবে ই ১নং বৰ্গৰ ক্ষাৰ ধাতু। সেয়েহে ই ছডিয়াম (Na)ৰ সৈতে একে বৰ্গত থাকে।
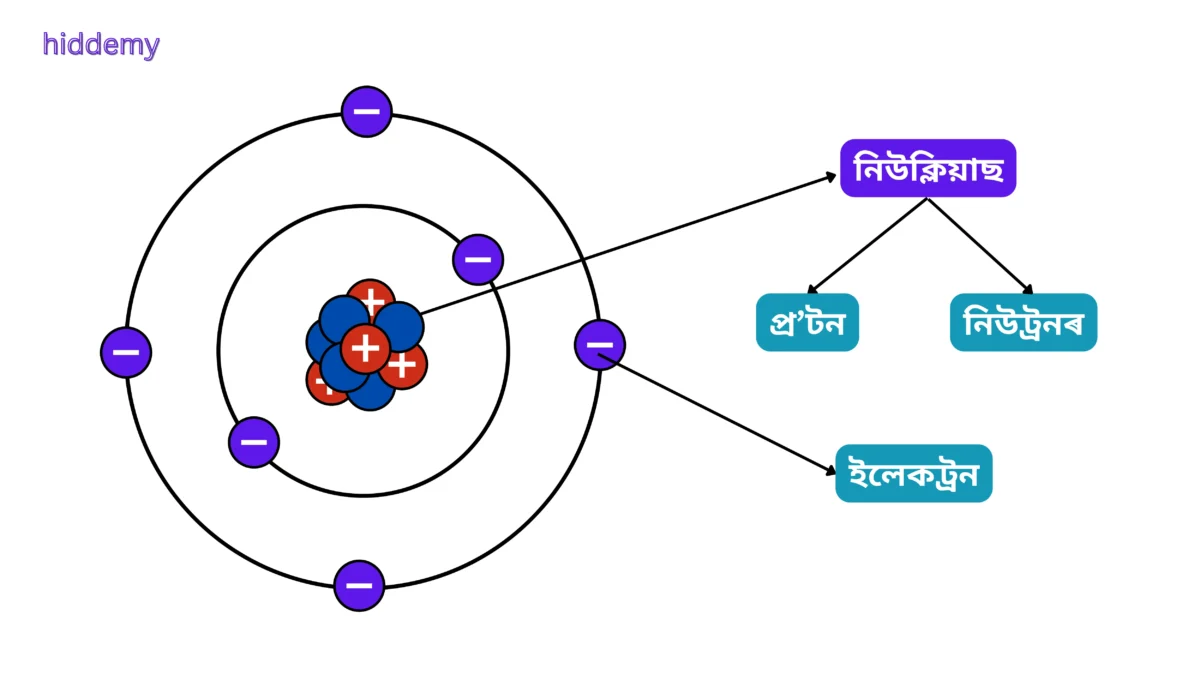
4. পৰমাণু কাক বোলে?
(a) মৌলৰ আটাইতকৈ ডাঙৰ কণা
(b) মৌলৰ আটাইতকৈ সৰু কণা
(c) পৰমাণুৰ নিউক্লিয়াছৰ অংশ
(d) ইলেকট্রনৰ সমষ্টি
উত্তৰ: (b) মৌলৰ আটাইতকৈ সৰু কণা
ব্যাখ্যা: পৰমাণু হৈছে মৌলৰ আটাইতকৈ ক্ষুদ্ৰতম কণা। যিটো প্ৰ’টন, ইলেকট্রন আৰু নিউট্রনৰে গঠিত।
5. অণু কেনেকৈ গঠন হয়?
(a) এটা পৰমাণুৰ দ্বাৰা
(b) দুই বা ততোধিক পৰমাণু ল'গ লাগি
(c) কেৱল নিউক্লিয়াছৰ দ্বাৰা
(d) কেৱল প্ৰ’টনৰ দ্বাৰা
উত্তৰ: (b) দুই বা ততোধিক পৰমাণুৰ ল'গ লাগি
ব্যাখ্যা: দুই বা ততোধিক একেই বা ভিন্ন পৰমাণু ল'গ লাগি অণু গঠিত হয়। যেনে O₂ বা H₂O।
6. মৌলৰ শ্রেণীবিভাজনৰ মূল উদ্দেশ্য কি?
(a) মৌলৰ সংখ্যা বৃদ্ধি কৰা
(b) মৌলৰ অধ্যয়ন সহজ কৰা
(c) মৌলৰ ধৰ্ম পৰিৱৰ্তন কৰা
(d) মৌলৰ পাৰমাণৰিক ভৰ হ্রাস কৰা
উত্তৰ: (b) মৌলৰ অধ্যয়ন সহজ কৰা
ব্যাখ্যা: মৌলসমূহ ধৰ্মৰ সাদৃশ্যতাৰ ওপৰত ভিত্তি কৰি বৰ্গ আৰু পৰ্যায়ত শ্রেণীবিভাজন কৰা হয়। যাৰ ফলত মৌলসমূহৰ ধৰ্ম অধ্যয়ন কৰা সহজ সাধ্য হয়।
7. আধুনিক পৰ্যাবৃত্ত তালিকাত কেইটা পৰ্যায় আৰু বৰ্গ আছে?
(a) 7 পৰ্যায়, 18 বৰ্গ
(b) 18 পৰ্যায়, 7 বৰ্গ
(c) 7 পৰ্যায়, 7 বৰ্গ
(d) 18 পৰ্যায়, 18 বৰ্গ
উত্তৰ: (a) 7 পৰ্যায়, 18 বৰ্গ
ব্যাখ্যা: আধুনিক পৰ্যাবৃত্ত তালিকাত 7টা অনুভূমিক পৰ্যায় আৰু 18টা উলম্ব বৰ্গ থাকে।
8. ক্ষাৰ ধাতু কোন বৰ্গৰ মৌল?
(a) বৰ্গ 1
(b) বৰ্গ 2
(c) বৰ্গ 17
(d) বৰ্গ 18
উত্তৰ: (a) বৰ্গ 1
ব্যাখ্যা: ক্ষাৰ ধাতু, যেনে লিথিয়াম (Li), ছডিয়াম (Na), পটাছিয়াম (K) আদি ১নং বৰ্গত থাকে আৰু ইহঁত অত্যন্ত সক্ৰিয়।
9. সম্ভ্রান্ত গেছৰ যোজ্যতা কিমান?
(a) 1
(b) 2
(c) 0
(d) 7
উত্তৰ: (c) 0
ব্যাখ্যা: সম্ভ্রান্ত গেছৰ বাহিৰৰ খোলা সম্পূৰ্ণ পূৰ্ণ হৈ থাকে বাবে ইহঁতৰ যোজ্যতা শূন্য হয়।
10. হেল’জেন মৌল কোন বৰ্গত অৱস্থিত?
(a) বৰ্গ 1
(b) বৰ্গ 2
(c) বৰ্গ 17
(d) বৰ্গ 18
উত্তৰ: (c) বৰ্গ 17
ব্যাখ্যা: হেল’জেন, যেনে ফ্লুৰিন (F), ক্ল’ৰিন (Cl), ব্র’মিন (Br) আদি বৰ্গ 17ত থাকে আৰু ইহঁত অতিকৈ সক্ৰিয় অধাতু।
11. লেণ্ঠেনাইড মৌলৰ প্ৰকৃতি কি?
(a) অধাতু
(b) ধাতু
(c) ধাতুকল্প
(d) গেছ
উত্তৰ: (b) ধাতু
ব্যাখ্যা: লেণ্ঠেনাইড আৰু এক্টিনাইড মৌলবোৰ ধাতুৰ শ্রেণীত পৰে।
12. সংক্রমণশীল মৌল কোন বৰ্গত পোৱা যায়?
(a) বৰ্গ 1–2
(b) বৰ্গ 3–12
(c) বৰ্গ 13–17
(d) বৰ্গ 18
উত্তৰ: (b) বৰ্গ 3–12
ব্যাখ্যা: সংক্রমণশীল মৌল যেনে আইৰণ, ক’বাল্ট আদি বৰ্গ 3ৰ পৰা 12ত থাকে। ইহঁত আটাইবোৰ ধাতু।
13. ড’বাৰেইনাৰৰ ট্ৰায়াডত কেইটা মৌল থাকে?
(a) 2
(b) 3
(c) 4
(d) 5
উত্তৰ: (b) 3
ব্যাখ্যা: ড’বাৰেইনাৰৰ ট্ৰায়াডত তিনিটা মৌল থাকে। যেনে লিথিয়াম (Li), ছডিয়াম (Na), আৰু পটাছিয়াম (K)।
14. নিউলেণ্ডছৰ অষ্টক সূত্ৰ অনুসৰি কোনটো মৌলৰ ধৰ্ম পুনৰাবৃত্তি হয়?
(a) 6
(b) 7
(c) 8
(d) 9
উত্তৰ: (c) 8
ব্যাখ্যা: নিউলেণ্ডছৰ অষ্টক সূত্ৰ অনুসৰি প্ৰতি অষ্টম মৌলৰ ধৰ্ম প্ৰথম মৌলৰ সৈতে সাদৃশ্যপূৰ্ণ।
15. মেণ্ডেলিভৰ পৰ্যাবৃত্ত তালিকা কিহৰ ওপৰত ভিত্তি কৰি প্ৰস্তুত কৰা হৈছিল?
(a) পাৰমাণৰিক ভৰ
(b) পাৰমাণৰিক সংখ্যা
(c) ইলেকট্রনৰ সংখ্যা
(d) ৰাসায়নিক ধৰ্ম
উত্তৰ: (a) পাৰমাণৰিক ভৰ
ব্যাখ্যা: মেণ্ডেলিভে মৌলবোৰক সিহঁতৰ পাৰমাণৰিক ভৰৰ বৰ্দ্ধিত ক্ৰমত সজাই পৰ্যাবৃত্ত তালিকা প্ৰস্তুত কৰিছিল আৰু ৰাসায়নিক ধৰ্মৰ সাদৃশ্যৰ ওপৰত গুৰুত্ব দিছিল।
Understanding-Based Questions (16–30)
16. তলৰ কোনটো ধাতুকল্প মৌলৰ উদাহৰণ?
(a) ছডিয়াম (Na)
(b) জাৰ্মেনিয়াম (Ge)
(c) ক্ল’ৰিন (Cl)
(d) হিলিয়াম (He)
উত্তৰ: (b) জাৰ্মেনিয়াম (Ge)
ব্যাখ্যা: জাৰ্মেনিয়ামে ধাতু আৰু অধাতু দুয়োৰে ধৰ্ম প্ৰদৰ্শন কৰে, সেয়েহে ই ধাতুকল্প মৌল।
17. ক্ষাৰ ধাতুৰ তুলনাত ক্ষাৰকীয় মৃত্তিকা ধাতু কম সক্ৰিয় কিয়?
(a) ইহঁতৰ যোজক ইলেকট্রন 1
(b) ইহঁতৰ যোজক ইলেকট্রন 2
(c) ইহঁতৰ পাৰমাণৰিক আকাৰ কম
(d) ইহঁতৰ গলনাংক কম
উত্তৰ: (b) ইহঁতৰ যোজক ইলেকট্রন 2
ব্যাখ্যা: ক্ষাৰকীয় মৃত্তিকা ধাতুৰ (বৰ্গ 2) যোজক ইলেকট্রন 2। যাৰ বাবে ইহঁত ক্ষাৰ ধাতুতকৈ কম সক্ৰিয়।
18. হেল’জেন মৌলৰ প্ৰধান বৈশিষ্ট্য কি?
(a) ইহঁত ৰাসায়নিকভাৱে নিষ্ক্ৰিয়
(b) ধাতুৰ সৈতে লৱণ গঠন কৰে
(c) যোজ্যতা শূন্য
(d) গলনাংক অতি উচ্চ
উত্তৰ: (b) ধাতুৰ সৈতে লৱণ গঠন কৰে
ব্যাখ্যা: হেল’জেন অধাতুবোৰ অতিকৈ সক্ৰিয়। ই ধাতুৰ সৈতে বিক্ৰিয়া কৰি লৱণ গঠন কৰে। যেনে NaCl।
19. ড’বাৰেইনাৰৰ ট্ৰায়াডৰ মাজৰ মৌলৰ পাৰমাণৰিক ভৰ কিহৰ সমান?
(a) আন দুটা মৌলৰ ভৰৰ যোগফল
(b) আন দুটা মৌলৰ ভৰৰ গড়
(c) আন দুটা মৌলৰ ভৰৰ বিয়োগফল
(d) আন দুটা মৌলৰ ভৰৰ গুণফল
উত্তৰ: (b) আন দুটা মৌলৰ ভৰৰ গড়
ব্যাখ্যা: ট্ৰায়াডৰ মাজৰ মৌলৰ পাৰমাণৰিক ভৰ আন দুটা মৌলৰ ভৰৰ গড় মানৰ সমান। যেনে Li (7), Na (23), K (39)।
20. নিউলেণ্ডছৰ অষ্টক সূত্ৰ কেলছিয়ামৰ পিছত কিয় প্ৰযোজ্য নহয়?
(a) মৌলৰ সংখ্যা অধিক হোৱাৰ বাবে
(b) ধৰ্মৰ পুনৰাবৃত্তি নোহোৱাৰ বাবে
(c) পাৰমাণৰিক ভৰ কম হোৱাৰ বাবে
(d) ইলেকট্রনৰ সংখ্যা সলনি হোৱাৰ বাবে
উত্তৰ: (b) ধৰ্মৰ পুনৰাবৃত্তি নোহোৱাৰ বাবে
ব্যাখ্যা: কেলছিয়ামৰ পিছত মৌলৰ ধৰ্ম অষ্টক সূত্ৰ মতে পুনৰাবৃত্তি নহয়। সেয়েহে সূত্ৰটো প্ৰযোজ্য নহয়।
21. মেণ্ডেলিভে পৰ্যাবৃত্ত তালিকাত কিয় খালি ঠাই এৰি গৈছিল?
(a) মৌলৰ সংখ্যা কমৰ বাবে
(b) নতুন মৌল সংযোজনৰ বাবে
(c) পাৰমাণৰিক ভৰ হ্রাসৰ বাবে
(d) ইলেকট্রনীয় বিন্যাসৰ বাবে
উত্তৰ: (b) নতুন মৌল সংযোজনৰ বাবে
ব্যাখ্যা: মেণ্ডেলিভে ভৱিষ্যতে আৱিষ্কৃত হ’বলগীয়া মৌলৰ বাবে তালিকাত খালি ঠাই এৰি থৈছিল।
22. আধুনিক পৰ্যাবৃত্ত তালিকাৰ ভিত্তি কি?
(a) পাৰমাণৰিক ভৰ
(b) পাৰমাণৰিক সংখ্যা
(c) ইলেকট্রনৰ সংখ্যা
(d) নিউট্রনৰ সংখ্যা
উত্তৰ: (b) পাৰমাণৰিক সংখ্যা
ব্যাখ্যা: হেনৰী ম’জলেৰ সূত্ৰ অনুসৰি মৌলৰ ধৰ্ম পাৰমাণৰিক সংখ্যাৰ পৰ্যায়ক্ৰমে সলনি হয়।
23. পৰ্যায় এটাত যোজক ইলেকট্রনৰ সংখ্যা কেনেকৈ সলনি হয়?
(a) একেই থাকে
(b) এককৈ বাঢ়ে
(c) এককৈ কমে
(d) দুগুণ হয়
উত্তৰ: (b) এককৈ বাঢ়ে
ব্যাখ্যা: পৰ্যায় এটাত বাওঁফালৰ পৰা সোঁফাললৈ পাৰমাণৰিক সংখ্যাৰ সৈতে যোজক ইলেকট্রন এককৈ বাঢ়ে।
24. বৰ্গ এটাত ওপৰৰ পৰা তললৈ খোলাৰ সংখ্যা কেনেকৈ সলনি হয়?
(a) একেই থাকে
(b) বাঢ়ে
(c) কমে
(d) শূন্য হয়
উত্তৰ: (b) বাঢ়ে
ব্যাখ্যা: বৰ্গ এটাত ওপৰৰ পৰা তললৈ গ’লে নতুন খোলাৰ সংখ্যা বাঢ়ে।
25. ধাতুৰ অক্সাইডৰ প্ৰকৃতি কেনেকুৱা?
(a) আম্লিক
(b) ক্ষাৰকীয়
(c) নিৰপেক্ষ
(d) দুয়োটা
উত্তৰ: (b) ক্ষাৰকীয়
ব্যাখ্যা: ধাতুৰ অক্সাইড সাধাৰণতে ক্ষাৰকীয় প্ৰকৃতিৰ। যেনে Na₂O এ পানীৰ সৈতে বিক্ৰিয়া কৰি NaOH গঠন কৰে।
26. অধাতুৰ অক্সাইডৰ প্ৰকৃতি কি?
(a) ক্ষাৰকীয়
(b) আম্লিক
(c) নিৰপেক্ষ
(d) দুয়োটা
উত্তৰ: (b) আম্লিক
ব্যাখ্যা: অধাতুৰ অক্সাইড সাধাৰণতে আম্লিক প্ৰকৃতিৰ। যেনে CO₂ এ পানীৰ সৈতে বিক্ৰিয়া কৰি H₂CO₃ গঠন কৰে।
27. পৰমাণৰিক আকাৰ কি এককত প্ৰকাশ কৰা হয়?
(a) মিটাৰ
(b) নেন’মিটাৰ
(c) পিক’মিটাৰ
(d) চেন্টিমিটাৰ
উত্তৰ: (c) পিক’মিটাৰ
ব্যাখ্যা: পৰমাণৰিক আকাৰ পিক’মিটাৰত প্ৰকাশ কৰা হয়। যেনে হাইড্ৰ’জেনৰ ব্যাসাৰ্ধ 37 pm।
28. বৰ্গ এটাত তললৈ গ’লে ধাতৱীয় ধৰ্ম কেনেকৈ পৰিৱৰ্তিত হয়?
(a) কমে
(b) বাঢ়ে
(c) একেই থাকে
(d) শূন্য হয়
উত্তৰ: (b) বাঢ়ে
ব্যাখ্যা: বৰ্গ এটাত তললৈ গ’লে পাৰমাণৰিক আকাৰ বাঢ়ে। যাৰ ফলত ইলেকট্রন হেৰুৱাৰ ক্ষমতা বৃদ্ধি পায়। অৰ্থাৎ সহজে ইলেকট্রন হেৰুওৱা মৌলবোৰ অধিক ধাতৱীয় গুণসম্পন্ন।
29. পৰ্যায় এটাত বাওঁফালৰ পৰা সোঁফাললৈ অধাতৱীয় ধৰ্মৰ প্ৰৱণতা কেনেকুৱা?
(a) কমে
(b) বাঢ়ে
(c) একেই থাকে
(d) শূন্য হয়
উত্তৰ: (b) বাঢ়ে
ব্যাখ্যা: পৰ্যায় এটাত বাওঁফালৰ পৰা সোঁফাললৈ নিউক্লীয় আধানৰ মান বাঢ়ে। যাৰ ফলত ইলেকট্রন গ্ৰহণৰ ক্ষমতা বৃদ্ধি পায়। অৰ্থাৎ সহজে ইলেকট্রন লাভ কৰা মৌলবোৰ অধিক অধাতৱীয় গুণসম্পন্ন।
30. পৰ্যাবৃত্ত তালিকাত স্থানৰ ওপৰত ভিত্তি কৰি তলৰ কোন মৌলৰ ধাতৱীয় ধৰ্ম সৰ্বাধিক?
(a) Ga
(b) Ge
(c) As
(d) Se
উত্তৰ: (a) Ga
ব্যাখ্যা: গেলিয়াম (Ga) বৰ্গ 13ত থাকে। আনহাতে Ge, As, আৰু Se বৰ্গ 14, 15, আৰু 16ত থাকে। যিহেতু বাওঁফালৰ পৰা সোঁফাললৈ ধাতৱীয় ধৰ্ম কমে, সেয়েহে Gaৰ ধাতৱীয় ধৰ্ম সৰ্বাধিক।
Skill-Based Questions (31–40)
31. ব’ৰণ এটা অধাতু আৰু পৰ্যাবৃত্ত তালিকাৰ বৰ্গ 13 আৰু পৰ্যায় 2ত অৱস্থিত। ই অন্য মৌলৰ সৈতে কেনেকৈ বান্ধনি গঠন কৰে?
(a) 5টা ইলেকট্রনৰ ভাগ-বতৰা কৰি
(b) 3টা ইলেকট্রনৰ ভাগ-বতৰা কৰি
(c) 2টা ইলেকট্রনৰ ভাগ-বতৰা কৰি
(d) 1টা ইলেকট্রনৰ ভাগ-বতৰা কৰি
উত্তৰ: (b) 3টা ইলেকট্রনৰ ভাগ-বতৰা কৰি
ব্যাখ্যা: ব’ৰণৰ ইলেকট্রনীয় বিন্যাস 2, 3। ইয়াৰ যোজক ইলেকট্রন 3। যাৰ ফলত ই 3টা ইলেকট্রন ভাগ-বটোৰা কৰি সহযোজী বান্ধনি গঠন কৰে।
32. আধুনিক পৰ্যাবৃত্ত তালিকাত পৰ্যায়ৰ দিশে যোজ্যতাৰ প্ৰৱণতা কেনেকৈ সলনি হয়?
(a) বাওঁফালৰ পৰা সোঁফাললৈ বাঢ়ে
(b) সোঁফালৰ পৰা বাওঁফাললৈ কমে
(c) বাঢ়ে আৰু তাৰ পিছত কমে
(d) কমে আৰু তাৰ পিছত বাঢ়ে
উত্তৰ: (c) বাঢ়ে আৰু তাৰ পিছত কমে
ব্যাখ্যা: পৰ্যায় এটাত যোজক ইলেকট্রন 1ৰ পৰা 4লৈ বাঢ়ে (যোজ্যতা বাঢ়ে)। তাৰ পিছত 5ৰ পৰা 7লৈ ইলেকট্রন গ্ৰহণ কৰাৰ বাবে যোজ্যতা কমে।
33. এটা মৌলৰ ইলেকট্রনীয় বিন্যাস 2, 8, 8 হ’লে ই কোন শ্রেণীৰ অন্তৰ্গত?
(a) ক্ষাৰ ধাতু
(b) সম্ভ্রান্ত গেছ
(c) হেল’জেন
(d) সংক্রমণশীল মৌল
উত্তৰ: (b) সম্ভ্রান্ত গেছ
ব্যাখ্যা: 2, 8, 8 বিন্যাসৰ মৌলৰ বাহিৰৰ খোলা সম্পূৰ্ণ পূৰ্ণ হৈ থাকে। ইহঁতক সম্ভ্রান্ত গেছ বুলি কোৱা হয়। যেনে আৰ্গন (Ar)।
34. পাৰমাণৰিক সংখ্যা 11 হ’লে মৌলৰ যোজ্যতা কিমান?
(a) 1
(b) 2
(c) 3
(d) 0
উত্তৰ: (a) 1
ব্যাখ্যা: পাৰমাণৰিক সংখ্যা 11 হৈছে ছডিয়াম (Na)। যাৰ ইলেকট্রনীয় বিন্যাস 2, 8, 1। যোজক ইলেকট্রন 1 হোৱাৰ বাবে যোজ্যতা 1।
35. 37 pm পাৰমাণৰিক ব্যাসাৰ্ধৰ মৌল কোনটো?
(a) হাইড্ৰ’জেন
(b) লিথিয়াম
(c) ছডিয়াম
(d) পটাচিয়াম
উত্তৰ: (a) হাইড্ৰ’জেন
ব্যাখ্যা: হাইড্ৰ’জেনৰ পাৰমাণৰিক ব্যাসাৰ্ধ 37 pm। যিটো পৰ্যাবৃত্ত তালিকাত সৰ্বনিম্ন।
36. ধাতুৰ বিদ্যুৎ ধনাত্মক ধৰ্মৰ কাৰণ কি?
(a) ইলেকট্রন গ্ৰহণ
(b) ইলেকট্রন হেৰুৱা
(c) নিউট্রন বৃদ্ধি
(d) প্ৰ’টন হ্রাস
উত্তৰ: (b) ইলেকট্রন হেৰুৱা
ব্যাখ্যা: ধাতুবোৰে ইলেকট্রন হেৰুৱাই ধনাত্মক আয়ন গঠন কৰে। যাৰ ফলত ইহঁত বিদ্যুৎ ধনাত্মক মৌল।
37. অধাতুৰ বিদ্যুৎ ঋণাত্মক ধৰ্মৰ কাৰণ কি?
(a) ইলেকট্রন হেৰুৱা
(b) ইলেকট্রন গ্ৰহণ
(c) প্ৰ’টন বৃদ্ধি
(d) নিউট্রন হ্রাস
উত্তৰ: (b) ইলেকট্রন গ্ৰহণ
ব্যাখ্যা: অধাতুবোৰে ইলেকট্রন গ্ৰহণ কৰি ঋণাত্মক আয়ন গঠন কৰে। যাৰ ফলত ইহঁত বিদ্যুৎ ঋণাত্মক মৌল।
38. ক’বাল্ট আৰু নিকেলৰ সৈতে কোন মৌলৰ ধৰ্মৰ সাদৃশ্য আছে?
(a) আইৰণ (Fe)
(b) কেলচিয়াম (Ca)
(c) ছডিয়াম (Na)
(d) আৰ্গন (Ar)
উত্তৰ: (a) আইৰণ (Fe)
ব্যাখ্যা: আইৰণ, ক’বাল্ট, আৰু নিকেল হৈছে সংক্রমণশীল মৌল আৰু ইহঁতৰ ৰাসায়নিক ধৰ্ম একে।
39. মেণ্ডেলিভে কোনটো মৌলক একা-এলুমিনিয়াম নাম দিছিল?
(a) স্কেনডিয়াম
(b) গেলিয়াম
(c) জাৰ্মেনিয়াম
(d) ছিলিকন
উত্তৰ: (b) গেলিয়াম
ব্যাখ্যা: মেণ্ডেলিভে গেলিয়ামক একা-এলুমিনিয়াম নাম দিছিল। যিটো পাছত আৱিষ্কৃত হৈছিল।
40. সাধাৰণ মৌল কোন বৰ্গৰ অন্তৰ্গত?
(a) বৰ্গ 3–12
(b) বৰ্গ 1, 2, 13–17
(c) বৰ্গ 18
(d) বৰ্গ 1–18
উত্তৰ: (b) বৰ্গ 1, 2, 13–17
ব্যাখ্যা: সাধাৰণ মৌলবোৰ বৰ্গ 1, 2, আৰু 13–17ত থাকে। য’ত যোজক ইলেকট্রনৰ মান 1ৰ পৰা 7 হয়।
Application-Based Questions (41–50)
41. যোজক ইলেকট্রন 6 হ’লে মৌলৰ যোজ্যতা কিমান?
(a) 1
(b) 2
(c) 3
(d) 4
উত্তৰ: (b) 2
ব্যাখ্যা: 6টা যোজক ইলেকট্রন থকা মৌলই (যেনে অক্সিজেন) 2টা ইলেকট্রন গ্ৰহণ কৰি সুস্থিৰ হয়। সেয়েহে ইয়াৰ যোজ্যতা 2।
42. পাৰমাণৰিক সংখ্যা 17 হ’লে মৌলটো কোন শ্রেণীৰ অন্তৰ্গত?
(a) ক্ষাৰ ধাতু
(b) হেল’জেন
(c) সম্ভ্রান্ত গেছ
(d) সংক্রমণশীল মৌল
উত্তৰ: (b) হেল’জেন
ব্যাখ্যা: পাৰমাণৰিক সংখ্যা 17 হৈছে ক্ল’ৰিনৰ (Cl)। যাক হেল’জেন মৌল বুলি কোৱা হয়।
43. এটা মৌলৰ অক্সাইডে পানীৰ সৈতে আম্ল গঠন কৰে। মৌলটো কি প্ৰকৃতিৰ?
(a) ধাতু
(b) অধাতু
(c) ধাতুকল্প
(d) সম্ভ্রান্ত গেছ
উত্তৰ: (b) অধাতু
ব্যাখ্যা: অধাতুৰ অক্সাইডৰ প্ৰকৃতি হৈছে আম্লিক। আৰু ই পানীৰ সৈতে বিক্ৰিয়া কৰি আম্ল গঠন কৰে। যেনে CO₂ এ পানীৰ সৈতে বিক্ৰিয়া কৰি H₂CO₃ গঠন কৰে।
44. যদি এটা মৌলৰ পাৰমাণৰিক সংখ্যা 19 হয়, তেন্তে ই কোন বৰ্গৰ অন্তৰ্গত?
(a) বৰ্গ 1
(b) বৰ্গ 2
(c) বৰ্গ 17
(d) বৰ্গ 18
উত্তৰ: (a) বৰ্গ 1
ব্যাখ্যা: পাৰমাণৰিক সংখ্যা 19 হৈছে পটাছিয়ামৰ (K)। যিটো বৰ্গ 1ৰ অন্তৰ্গত ক্ষাৰ ধাতু।
45. এটা মৌলৰ ইলেকট্রনীয় বিন্যাস 2, 8, 2 হ’লে ইয়াৰ ধৰ্ম কি?
(a) অধাতৱীয়
(b) ধাতৱীয়
(c) ধাতুকল্প
(d) নিষ্ক্ৰিয়
উত্তৰ: (b) ধাতৱীয়
ব্যাখ্যা: 2, 8, 2 বিন্যাসৰ মৌলটো হৈছে মেগনেছিয়াম (Mg)। যিটো বৰ্গ 2ৰ অন্তৰ্গত আৰু ই এটা ধাতু।
46. কোন মৌলৰ অক্সাইডে NaOH গঠন কৰে?
(a) কাৰ্বন
(b) ছডিয়াম
(c) ফছফৰাছ
(d) ছালফাৰ
উত্তৰ: (b) ছডিয়াম
ব্যাখ্যা: ছডিয়ামৰ অক্সাইডে (Na₂O) পানীৰ সৈতে বিক্ৰিয়া কৰি ক্ষাৰকীয় NaOH গঠন কৰে।
47. যদি এটা মৌলৰ যোজক ইলেকট্রন 4 হয়, তেন্তে ইয়াৰ বান্ধনিৰ ধৰণ কি হ’ব পাৰে?
(a) আয়নীয়
(b) সহযোজী
(c) ধাতৱীয়
(d) দুয়োটা (a) আৰু (b)
উত্তৰ: (d) দুয়োটা (a) আৰু (b)
ব্যাখ্যা: 4টা যোজক ইলেকট্রনৰ মৌলই (যেনে ছিলিকন) আয়নীয় বা সহযোজী দুয়োটা বান্ধনি গঠন কৰিব পাৰে।
48. পৰ্যাবৃত্ত তালিকাত তলৰ কোনটো মৌলই ক্ল’ৰিন (Cl)ৰ সৈতে সহযোজী বান্ধনি গঠন কৰাৰ সম্ভাৱনা সৰ্বাধিক?
(a) ছডিয়াম (Na)
(b) কাৰ্বন (C)
(c) পটাছিয়াম (K)
(d) মেগনেছিয়াম (Mg)
উত্তৰ: (b) কাৰ্বন (C)
ব্যাখ্যা: ক্ল’ৰিন এটা অধাতু আৰু ই ইলেকট্ৰন ভাগ-বতৰাৰ জৰিয়তে অন্য অধাতু বা ধাতুকল্পৰ সৈতে সহযোজী বান্ধনি গঠন কৰে। যেনে কাৰ্বনৰ যোজক ইলেকট্ৰন 4টা আৰু ই ক্ল’ৰিনৰ সৈতে সহযোজী বান্ধনি গঠন কৰি CCl₄ উৎপন্ন কৰে। আনহাতে, Na, K, আৰু Mg ধাতু হোৱাৰ বাবে ক্ল’ৰিনৰ সৈতে আয়নীয় বান্ধনি গঠন কৰে।
49. মেণ্ডেলিভৰ তালিকাত হাইড্ৰ’জেনৰ স্থান নিৰ্ধাৰণ কৰাত কি সমস্যা হৈছিল?
(a) ইয়াৰ পাৰমাণৰিক ভৰ অজ্ঞাত
(b) ইয়াৰ ধৰ্ম ধাতু আৰু অধাতুৰ মিশ্ৰণ
(c) ইয়াৰ যোজ্যতা শূন্য
(d) ইয়াৰ ইলেকট্রন বিন্যাস অস্থিৰ
উত্তৰ: (b) ইয়াৰ ধৰ্ম ধাতু আৰু অধাতুৰ মিশ্ৰণ
ব্যাখ্যা: হাইড্ৰ’জেনৰ ধাতৱীয় আৰু অধাতৱীয় ধৰ্মৰ বাবে ইয়াৰ সঠিক স্থান নিৰ্ধাৰণ কৰা কঠিন আছিল।
50. এটা মৌলৰ পাৰমাণৰিক সংখ্যা 20 হ’লে ই কোন শ্রেণীৰ অন্তৈ?
(a) ক্ষাৰ ধাতু
(b) ক্ষাৰকীয় মৃত্তিকা ধাতু
(c) হেল’জেন
(d) সম্ভ্রান্ত গেছ
উত্তৰ: (b) ক্ষাৰকীয় মৃত্তিকা ধাতু
ব্যাখ্যা: পাৰমাণৰিক সংখ্যা 20 হৈছে কেলচিয়ামৰ (Ca)। যিটো বৰ্গ 2ৰ অন্তৰ্গত ক্ষাৰকীয় মৃত্তিকা ধাতু।
Assertion-Reason Questions (51–53)
51. উক্তি (A): পৰ্যাবৃত্ত তালিকাৰ পৰ্যায় এটাত ধাতৱীয় ধৰ্ম বাওঁফালৰ পৰা সোঁফাললৈ কমে।
কাৰণ (R): নিউক্লীয় আধানৰ মান বৃদ্ধিৰ ফলত ইলেকট্রন হেৰুৱাৰ ক্ষমতা কমে।
(a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
(b) A আৰু R দুয়োটা শুদ্ধ, কিন্তু R, Aৰ শুদ্ধ ব্যাখ্যা নহয়।
(c) A শুদ্ধ, কিন্তু R ভুল।
(d) A ভুল, কিন্তু R শুদ্ধ।
উত্তৰ: (a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
ব্যাখ্যা: পৰ্যাবৃত্ত তালিকাৰ পৰ্যায় এটাত বাওঁফালৰ পৰা সোঁফাললৈ গ’লে নিউক্লীয় আধান বৃদ্ধি পায়, যাৰ ফলত ইলেকট্রন হেৰুৱাৰ ক্ষমতা কমে। এই কাৰণে ধাতৱীয় ধৰ্ম হ্রাস পায়। সেয়েহে উক্তি (A) আৰু কাৰণ (R) দুয়োটা শুদ্ধ আৰু R হৈছে Aৰ শুদ্ধ ব্যাখ্যা।
52. উক্তি (A): আধুনিক পৰ্যাবৃত্ত তালিকা পাৰমাণৰিক সংখ্যাৰ ওপৰত ভিত্তি কৰি গঠন কৰা হৈছে।
কাৰণ (R): পাৰমাণৰিক সংখ্যাই মৌলৰ ৰাসায়নিক ধৰ্ম নিৰ্ধাৰণ কৰে।
(a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
(b) A আৰু R দুয়োটা শুদ্ধ, কিন্তু R, Aৰ শুদ্ধ ব্যাখ্যা নহয়।
(c) A শুদ্ধ, কিন্তু R ভুল।
(d) A ভুল, কিন্তু R শুদ্ধ।
উত্তৰ: (a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
ব্যাখ্যা: আধুনিক পৰ্যাবৃত্ত তালিকা হেনৰী ম’জলেৰ সূত্ৰ অনুসৰি পাৰমাণৰিক সংখ্যাৰ ওপৰত ভিত্তি কৰি গঠন কৰা হৈছে। পাৰমাণৰিক সংখ্যাৰ ওপৰত মৌলৰ ৰাসায়নিক ধৰ্ম নিৰ্ভৰ কৰে, কিয়নো ই ইলেকট্রনৰ বিন্যাস নিৰ্ধাৰণ কৰে। সেয়েহে A আৰু R দুয়োটা শুদ্ধ আৰু R হৈছে Aৰ শুদ্ধ ব্যাখ্যা।
53. উক্তি (A): সম্ভ্রান্ত গেছৰ যোজ্যতা শূন্য।
কাৰণ (R): সম্ভ্রান্ত গেছৰ বাহিৰৰ খোলা সম্পূৰ্ণ পূৰ্ণ হৈ থাকে।
(a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
(b) A আৰু R দুয়োটা শুদ্ধ, কিন্তু R, Aৰ শুদ্ধ ব্যাখ্যা নহয়।
(c) A শুদ্ধ, কিন্তু R ভুল।
(d) A ভুল, কিন্তু R শুদ্ধ।
উত্তৰ: (a) A আৰু R দুয়োটা শুদ্ধ আৰু R হ’ল Aৰ শুদ্ধ ব্যাখ্যা।
ব্যাখ্যা: সম্ভ্রান্ত গেছৰ (যেনে হিলিয়াম, নিয়ন, আৰ্গন) বাহিৰৰ খোলা সম্পূৰ্ণ পূৰ্ণ হৈ থাকে (2 বা 8 ইলেকট্রন), যাৰ ফলত ইহঁত ৰাসায়নিকভাৱে নিষ্ক্ৰিয় আৰু যোজ্যতা শূন্য হয়। সেয়েহে A আৰু R দুয়োটা শুদ্ধ আৰু R হৈছে Aৰ শুদ্ধ ব্যাখ্যা।
Case-Based Questions (54–55)
54. তলৰ কোনবোৰ মৌল ধাতুকল্প?
(i) ব’ৰন (B)
(ii) ছিলিকন (Si)
(iii) ছডিয়াম (Na)
(iv) জাৰ্মেনিয়াম (Ge)
(a) (i) আৰু (ii) শুদ্ধ
(b) (i), (ii) আৰু (iv) শুদ্ধ
(c) (ii) আৰু (iii) শুদ্ধ
(d) (iii) আৰু (iv) শুদ্ধ
উত্তৰ: (b) (i), (ii) আৰু (iv) শুদ্ধ
ব্যাখ্যা: ব’ৰন, ছিলিকন, আৰু জাৰ্মেনিয়ামে ধাতু আৰু অধাতু উভয়ৰে ধৰ্ম প্ৰদৰ্শন কৰে । সেয়েহে ইহঁতক ধাতুকল্প বুলি কোৱা হয়। ছডিয়াম এটা ধাতু।
55. তলৰ কোনবোৰ মৌলৰ ধৰ্মৰ পুনৰাবৃত্তি ড’বাৰেইনাৰৰ ট্ৰায়াডৰ উদাহৰণ?
(i) Li, Na, K
(ii) Cl, Br, I
(iii) Be, Mg, Ca
(iv) C, Si, Ge
(a) (i) আৰু (ii) শুদ্ধ
(b) (i) আৰু (iii) শুদ্ধ
(c) (ii) আৰু (iv) শুদ্ধ
(d) (i), (ii) আৰু (iii) শুদ্ধ
উত্তৰ: (b) (i) আৰু (iii) শুদ্ধ
ব্যাখ্যা: Li, Na, K আৰু Be, Mg, Ca ড’বাৰেইনাৰৰ ট্ৰায়াডৰ উদাহৰণ। কাৰণ ইহঁতৰ ধৰ্ম একে আৰু মাজৰ মৌলৰ পাৰমাণৱিক ভৰ আন দুটা মৌলৰ গড় মানৰ সমান।



