SEBA Class 10 Science Chapter 5 Detail Notes Periodic Classification of Elements | মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন
SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements (মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন) for HSLC 2026
Welcome to the complete SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements! These notes are specially prepared for Assamese Medium students appearing in the HSLC 2026 exam. If you're looking for well-organized, exam-oriented resources, this chapter guide is for you.
SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements includes all key topics—historical development, Mendeleev’s periodic table, modern periodic law, and periodic trends like atomic size, metallic character, and valency.
These SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements explain important groups such as alkali metals, halogens, and noble gases with examples and clear diagrams to support concept clarity.
Whether you're doing a detailed study or quick revision, SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements help you cover the syllabus efficiently.
For additional support, refer to the official NCERT Class 10 Science Book. Don't forget to explore the full SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements on our website.
SEBA Class 10 Science Chapter 5 Notes Periodic Classification of Elements | মৌলৰ পৰ্যাবৃত্ত শ্রেণীবিভাজন
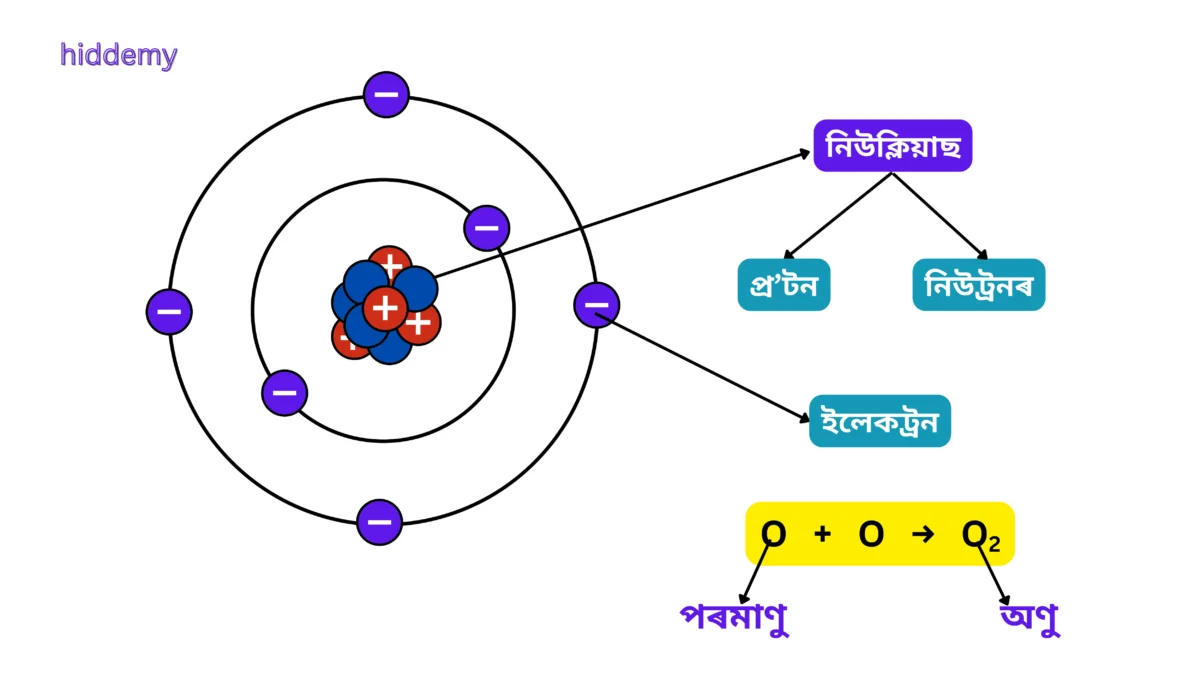
পৰমাণু আৰু অণু:
পৰমাণু (Atom):
কোনো মৌল বা পদাৰ্থত থকা আটাইতকৈ সৰু কণা।
- উদাহৰণ: অক্সিজেন (O), ফচফ'ৰাছ (P), হাইড্ৰ'জেন (H)।
- পৰমাণু - প্ৰ'টন, ইলেক্ট্ৰন আৰু নিউট্ৰনেৰে গঠিত।
- পৰমাণু এটা সুস্থিৰ হৈ নাথাকিবও পাৰে।
অণু (Molecule):
দুই বা ততোধিক পৰমাণু লগ লাগি অণু গঠন হয়।
- উদাহৰণ: অক্সিজেন - O₂, ফচফৰাছ - P₄, হাইড্ৰ'জেন - H₂।
- দুই বা ততোধিক একেই বা বেলেগ বেলেগ পৰমাণুৰে অণু গঠিত হয়।
- অণুবোৰ গঠন হ'লে সুস্থিৰ হৈ থাকে।
N.B: CO₂ আৰু H₂O একো একোটা যৌগ। এনেকুৱা বহু মৌল লগ লাগি কাৰ্বন ডাইঅক্সাইড আৰু পানীৰ সৃষ্টি কৰে।
মৌলৰ শ্রেণীবিভাজনৰ প্রয়োজনীয়তা:
বর্তমানে আমি ১১৮ টা মৌলৰ বিষয়ে জ্ঞাত। এই বৃহৎ সংখ্যক মৌলৰ প্রতিটোকে ব্যক্তিগতভাৱে অধ্যয়ন কৰাটো কষ্টসাধ্য আৰু বহু বছৰৰ প্রয়োজন হ'ব।
সেয়েহে ইয়াৰ সলনি ধৰ্মৰ সাদৃশ্যৰ ওপৰত ভিত্তি কৰি মৌলসমূহক কিছুমান গোষ্ঠীত বা শ্রেণীত বিভক্ত কৰা হৈছে। এই শ্রেণীসমূহৰ অধ্যয়নৰ দ্বাৰা মৌলসমূহক জানিবলৈ বেছি সহজসাধ্য হয়।
এইবাবে মৌলসমূহৰ শ্রেণীবিভাজন কৰা হয়।
- ১৮০০ চনত ৩০ টা মৌল আৰু ১৮৬৫ চনত ৬৩ টা মৌলৰ বিষয়ে জানিছিল।
- বর্তমান ১১৮ টা মৌলৰ বিষয়ে জানোঁ।
পৰ্যাবৃত্ত তালিকাৰ অধ্যয়ন:
মৌলৰ প্রধান শ্রেণীবিভাজন:
- ধাতু (Metals)
- অধাতু (Non-Metals)
- ধাতুকল্প (Metalloids)
পৰ্যাবৃত্ত তালিকাৰ গঠন:
- ৭ টা পৰ্যায় (Periods) – অনুভূমিক শাৰী।
- ১৮ টা বৰ্গ (Groups) – উলম্ব স্তম্ভ।
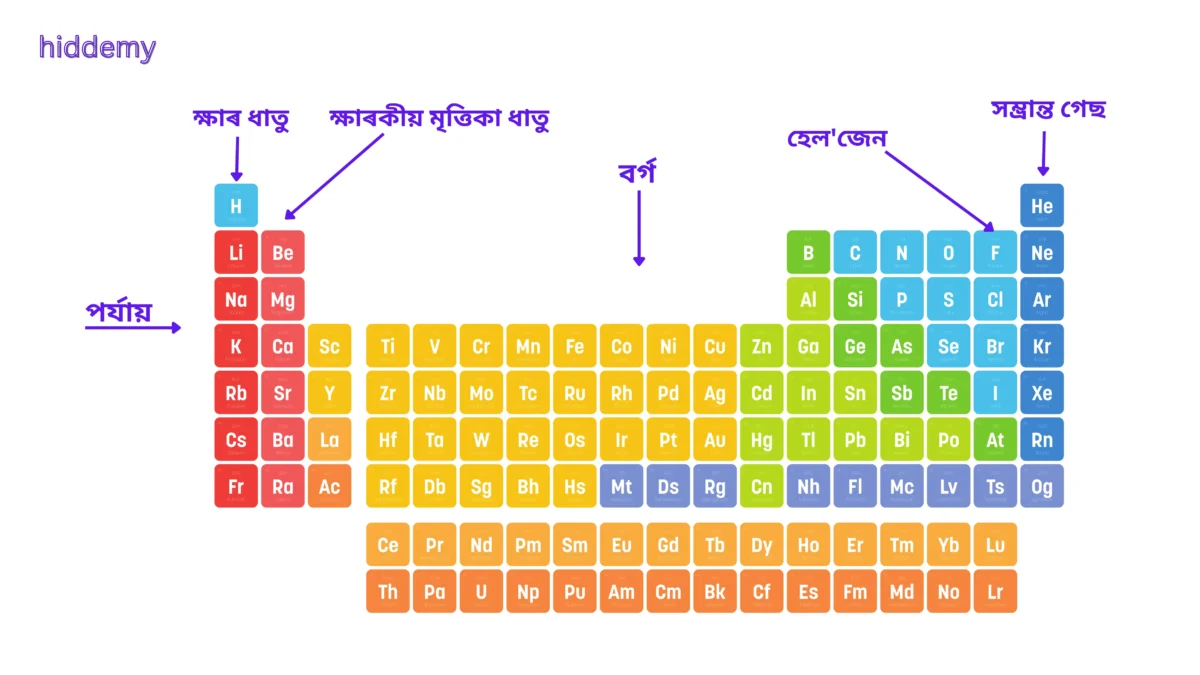
চিত্ৰ: পৰ্যাবৃত্ত তালিকাৰ গঠন
প্ৰধান মৌলৰ শ্রেণীবিভাজন:
ক্ষাৰ ধাতু (Alkali Metals):
- ১ বৰ্গ (Li, Na, K)
- ই অতিকৈ সক্রিয় মৌল, বিশেষকৈ পানীৰ ক্ষেত্রত।
- ই কোমল আৰু গলনাংক কম।
ক্ষাৰকীয় মৃত্তিকা ধাতু (Alkaline Earth Metals):
- ২ বৰ্গ (Be, Mg, Ca)
- সক্রিয় যদিও ১ বৰ্গৰ মৌলসমূহতকৈ কম।
- ই কঠিন আৰু গলনাংক বেছি।
সম্ভ্রান্ত গেছ (Noble Gases):
- ১৮ বৰ্গ (He, Ne, Ar)
- ইহঁতৰ বহিৰ্খোলত ৮টাকৈ ইলেক্ট্রন থাকে।
- অৱশ্যে হিলিয়ামৰ একমাত্র খোলত ২টা ইলেকট্রন থাকে।
- এই মৌলবোৰ ৰাসায়নিকভাৱে নিষ্ক্রিয়।
- ইহঁতৰ যোজ্যতা শূন্য, আয়নীকৰণ শক্তি অতি উচ্চ আৰু ইলেকট্রন আসক্তি শূন্য।
হেল'জেন (Halogens):
- ১৭ বৰ্গ (F, Cl, Br, I)
- অতিকে সক্রিয় অধাতু।
- ই ধাতুৰ সৈতে বিক্রিয়া কৰি লৱণ সৃষ্টি কৰে।
লেণ্ঠেনাইড (Lanthanides) আৰু এক্টিনাইড (Actinides):
- ওপৰৰ শাৰীৰ মৌলকেইটাক লেণ্ঠেনাইড বা লেণ্ঠান'ন আৰু তলৰ শাৰীৰ মৌলকেইটাক এক্টিনাইড বা এক্টিন'ন শ্রেণী বোলা হয়।
- ইহঁতবোৰ ধাতু।
সাধাৰণ মৌল (Representative Elements):
- পৰ্যাবৃত্ত তালিকাৰ ১, ২, ১৩, ১৪, ১৫, ১৬ আৰু ১৭ বৰ্গৰ মৌলবোৰক সাধাৰণ মৌল বুলি কোৱা হয়।
- এই বৰ্গবোৰত থকা মৌলবোৰৰ যোজক কক্ষত ক্রমান্বয়ে ১-ৰ পৰা ৭ টাকৈ ইলেক্ট্রন থাকে।
সংক্রমণশীল মৌল (Transition Elements):
- পৰ্যাবৃত্ত তালিকাৰ ৩-ৰ পৰা ১২ নং বৰ্গৰ মৌলবোৰক সংক্রমণশীল মৌল বুলি কোৱা হয়।
- এই বোৰৰ আটাইকেইটা ধাতু।
- ইহঁতে ৰঙীন যৌগ সৃষ্টি কৰে।
আন্তঃসংক্রমণশীল মৌল (Inner Transition Elements):
- মূল পৰ্যাবৃত্ত তালিকাৰ তলত থকা সমান্তৰাল শাৰী দুটাত স্থান দিয়া মৌলসমূহক আন্তঃসংক্রমণশীল মৌল বোলা হয়।
পৰ্যাবৃত্ত তালিকাৰ বিকাশ: ???????
Enroll in Our Class 10 Science Course!
Unlock the full SEBA Class 10 Science Chapter 5 – Periodic Classification of Elements experience with beautifully designed diagrams, detailed notes, and expert guidance. Perfect for HSLC 2026 preparation.

Class 10 Science Detail Notes Course FAQs
Course Details
Summary: This course is a complete package for SEBA Class 10 Science. It covers Physics, Chemistry, and Biology chapters with Assamese-medium explanations, diagrams, MCQs, previous year questions, and practice sets—all in one place for HSLC 2026.
Course Benefits
Summary: Get expert-made notes, interactive quizzes, downloadable PDFs, chapter-wise videos, and exam-focused MCQs. Designed for complete understanding and high score in Class 10 SEBA exams.
What You'll Learn
Summary: You will master chapters like Life Processes, Periodic Table, Electricity, Heredity, etc., with topic-wise videos, animations, NCERT-based questions, and bilingual (English–Assamese) support.
Duration & Format
Summary: Self-paced online course accessible anytime. Notes and videos available 24×7 with lifetime access after enrollment. Study at your own speed!
Who Should Join
Summary: Ideal for Class 10 SEBA students (Assamese Medium), especially those preparing for HSLC 2026. Also suitable for students who want visual learning, practice materials, and full revision help.



